高校で学習する化学の内容のコラムをまとめています。 化学コラム 3.組成式 イオンからなる物質は、イオンの種類と割合を元素記号で示した組成式で表す。 例えば、塩化ナトリウム(ナトリウムイオンNaと塩化物イオンClからなる)の組成式はNaClとなる。また、塩化カルシウム亜硝酸カリウム K N O 2 亜硝酸ナトリウム Na N O 2 亜硝酸ブチル C 4 H 9 N O 2 亜硝酸メチル CH 3 N O 2 アスコルビン酸 C 6 H 8 O 6 アスパラギン酸 C 4 H 7 N O 2 アスパルテーム C 14 H 18 N 2 O 5 アセチルコリン ( CH 3) 3 N CH 2 CH 2 O COCH 3 アセチルサリチル酸 · 物質を構成する原子と原子の数のもっとも簡単な比を表した式 これは、NaClのイオン結晶である岩塩です。 これは、NaとClがずっとイオン結合を連ねて、このような目に見える形になっているのです。 このように、無限にイオン結合が続いているわけですよ。 じゃあ、 分子式 みたいにその塊の原子の数を全部書き出したとします。 すると、この岩塩には、Na と

構造式の書き方 化学の基本として知っておきたいルールとは 高校生向け受験応援メディア 受験のミカタ
高校 化学 組成式 一覧
高校 化学 組成式 一覧-基礎化学 INDEX へ戻る 原子 番号 元素 英語 記号 原子量 1 水素 Hydrogen H 1008 2 ヘリウム · 高校の化学についてです。 組成式の一覧表みたいなのがあるサイトがあったら教えてください(><) 出来れば次の物質の組成式を教えてくれるとありがたいです・・・ ・塩化ナトリウム ・硝酸ナトリウム ・水酸化バリウム ・炭酸ナトリウム ・炭酸水素ナトリウム ・硫酸バリウム ・酸化カルシウム ・塩化マグネシウム ・酸化マグネシウム ・酸化銅(Ⅰ) ・酸化銅




高校化学が苦手な受験生必見 化学反応式の覚え方のコツをご紹介 予備校いくなら逆転合格の武田塾
ベンゼン環のある物質の構造式では、ベンゼン環の部分の構造を または または または などと略記する。この教科書では、いずれの書き方も用いる。 性質 ベンゼンは特有な臭いをもち、無色で揮発性の液体(沸点80℃、融点55℃)である。 人体には有毒水素 $$ h_2 $$ メタン化学 組成式は、化学で、物質に含まれている原子が何かを示すために用います。 しかし、化学では様々な種類の式が出てくるため、その区別がよく分からないという人もいるでしょう。 化学式は物質に含まれている元素の種類と数を示しているものなのに対して、組成
組成式は4を最も簡単な比にするので241となり、c2h4oとなります。 0 看護大合格する!!! 4年以上前 分子式は組成式に、 組成式は分子式に変えることも出来るってことですか?? 1 エソラ 4年以上前 すいません説明不足でした 分子式は組成式に変えることはできますが金属などにつ · 組成式はCaOになります。 硫酸カルシウムの場合、カルシウムイオンと硫酸イオンからできています。 Ca2 SO4 2 これで電荷の合計が0になるので、もう右上の数字は不要になります。組成式はCaSO4になります。 水酸化アルミニウムの場合、アルミニウムイオンと水酸化物イオンからできています。 Al3 OH 電荷の合計は2。正の電荷のほうが強いので、更にOHを(基礎1) 0から高校の有機化学を学びたい人や、授業がさっぱりわからない・・・という人に向けて、基礎の基礎から解説するシリーズの第1回です。 "有機"の言う言葉の意味から、基 Shu Yasuda 高分子
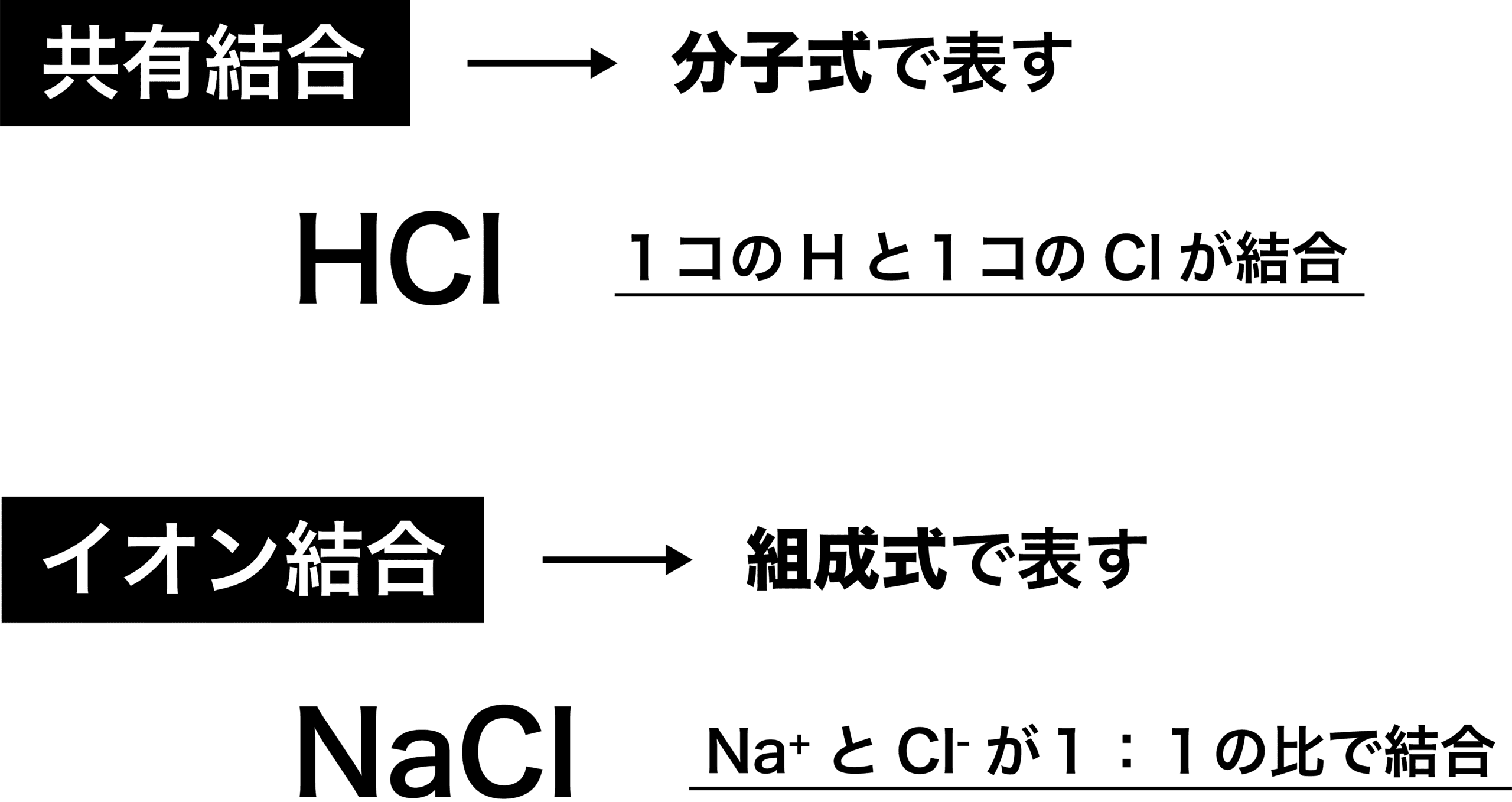
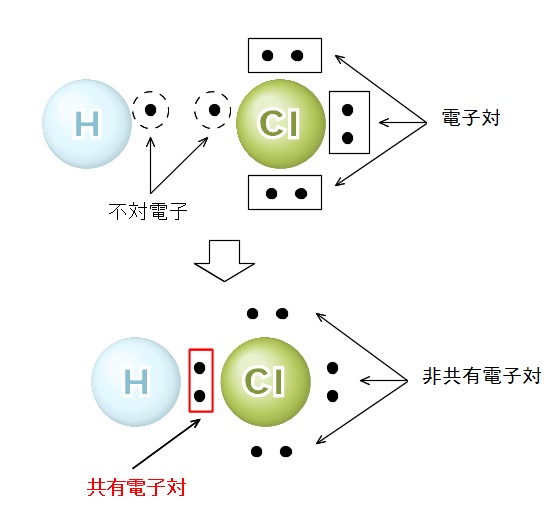
はじめに ここでは、化学式について説明をします。 この化学式を理解すれば、やっとスタートラインに立てますのでしっかりと気を引き締めていきましょう! 化学式とは 化学式とは4つの式の総称のことです。 分子式、イオン式、組成式、そして構造式です。陽イオンの価数×陽イオンの数=陰イオンの価数×陰イオンの数 「Al3」と「SO4 2 」をくっつけてみましょう。 上記の公式を使うと 3×陽イオンの数=2×陰イオンの数 ですので 陽イオンの数=2、陰イオンの数=3となり「Al2(SO4)3」ができあがります。 ・ 共有結合とイオン結合の違い~共有結合の例~ ・ 高校化学 共有結合における結合エネルギーの特徴 組成式If playback doesn't begin shortly, try restarting your device Videos you watch may be added to the TV's watch history and influence TV recommendations To avoid this, cancel and sign in to




イオン結合とは 例 結晶 共有結合との違い 半径 理系ラボ



酸化還元反応を解説 酸化数を理解して半反応式を覚えよう Studyplus スタディプラス
<その他の組成式> 炭酸水素ナトリウム NaHCO 3 硫酸水素ナトリウム NaHSO 4 亜硫酸水素ナトリウム NaHSO 3 酢酸ナトリウム CH 3 COONa 二酸化ケイ素 SiO 2化学式を書いてみて, 1種類の元素だけでできていれば単体, そうでなければ元素と判断してもよいでしょう。 アドバイス 原子の名称と単体の名称が同じ場合が多いので, 混乱しやすいところです。 普段から身の回りの物質を化学式で考えてみることで, 区別できるようにしていきましょう組成式を書くときにかっこを、どのようなときに書いたり、書かなかったりするんですか? 例 mg(oh)2 ai2(so4)3 na2co3 組成式 0 回答 ken 5年弱前 多原子イオンが複数ある時です。 1つ目の例 mg2 oh であれば、多原子イオンであるohが2つ必要なのでかっこがつきます。 2つ目の例 al3




高校化学基礎 組成式 練習編 映像授業のtry It トライイット



1
· 中学理科で学習する原子記号(元素記号)と化学式を一覧にまとめました。 原子記号(元素記号)は金属元素と非金属元素ごとにまとめ、原子記号(元素記号)の覚え方、化学式は単体と化合物ごとに紹介します。 高校入試対策として、原子記号と化学式を復習したい人におすすめです。 · 高校 の化学で、 組成式の式量の一覧はこちら ・naclとグルコースの分子量・式量。その他組成式の式量一覧。 スポンサーリンク レクタングル(大)広告 水、水素、酸素、窒素などの分子量一覧まとめ 分子名 分子式(分子の化学式) 分子量;高校化学Net参考書 ~基礎の反復演習問題「化学基礎」~ 高校化学Net参考書> 基礎の反復演習問題「化学基礎」> 組成式 組成式について 物質によっては,構成粒子の数が決まっていないものがあります。 その場合は,構成粒子の数を最も簡単な整数比で表す「組成式」が用いられます。 化学基礎で結晶の種類を4つ学習しますが,イオン結晶,共有結晶,金属
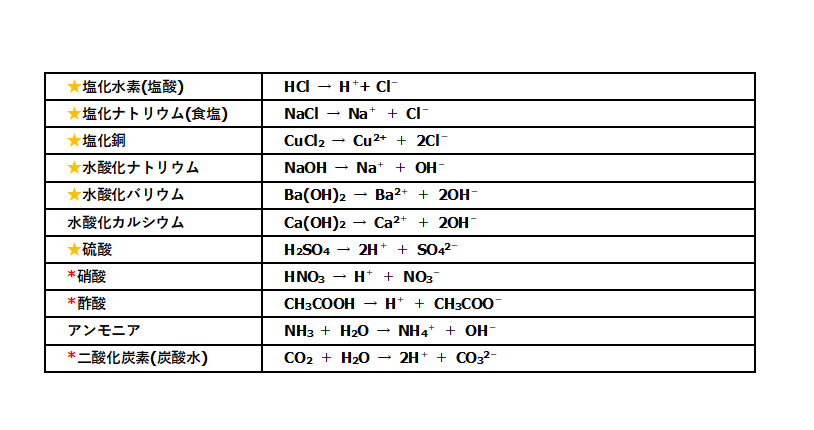



中3化学 電離 電解質 中学理科 ポイントまとめと整理




物質の構造と構成 の記事一覧 2 4ページ目
組成式一覧高校 原子数 組成式 示性式 IUPAC 慣用名 5 CF4 CF4 tetrafluoromethane (テトラフルオルメタン) carbon tetrafluoride (四フッ化炭素) 組成式c8h7o₂ 組成式の決定は,\ 有機化学分野の最重要事項である {「組成式の決定\ →\ 分子式の決定\ →\ 構造式の決定」}が有機化学の問題の基本的な流チェック 化学式 × 名称 × 1 H2 水素 2元素記号=組成式 原子量→式量 次の章では,銅の原子量を求める実験を紹介しましょう。高校生になって初めての化学実験ですね。お楽しみに。 それでは,この章の学習内容を確認しましょう。 1.原子量の規準になっている原子は何ですか? 2.二酸化炭素の分子量はいくらですね?ただし




P0rt 42 1 Descubre Como Resolverlo En Qanda



組成式 化学 塩化カルシウム
212 入試頻出の3大オキソ酸の化学式(分子式と構造式) 213 天然高分子の分子式と構造式;イオンを覚えていないと,多くの化合物や化学反応式を書くことができなくなってしまいます。 英単語を全く知らずに英文を書こうとするようなものです。 代表的なイオンを次に示しますので,確実に覚えておきましょう。 陽イオン(単原子イオン) 価数 イオン名 イオン式 1価 水素イオン · イオン式の一覧 を 東京を拠点に活動する理科教育学者 専門は理科教育学 所持教員免許は中学と高校の理科 理科の教材や学習法を研究中!ツイッターでは理科のポイントや勉強の仕方、さわにいの考えを発信しています。youtubeは年から勉強に役立つ理科動画を配信開始!ぜひ見
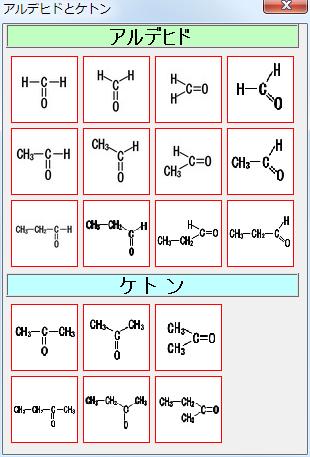



Microsoft Word Chemformbook Docx Pdf 無料ダウンロード



1 11 Cait 4 Dfracm Descubre Como Resolverlo En Qanda
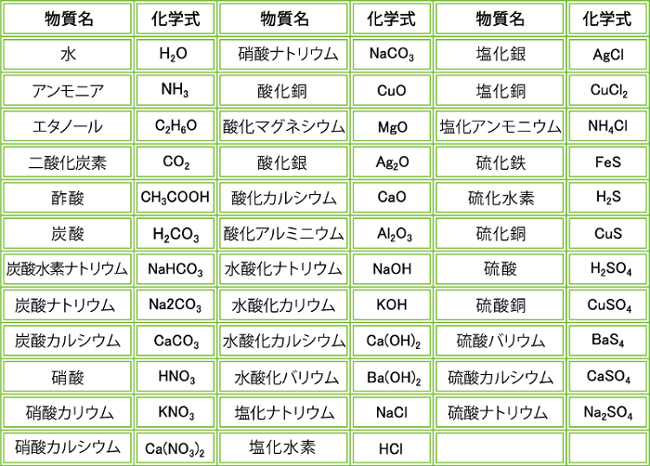
水 h 2 o アンモニア nh 3 一酸化炭素 co 二酸化炭素 co 2 一酸化窒素 no 二酸化窒素 no 2 二酸化硫黄 so 2 三酸化硫黄 so 3 過酸化水素 h 2 o 2 フッ化水素 hf 塩化水素 hcl 臭化水素 hbr ヨウ化水素 hi 二酸化ケイ素 sio 2 二酸化マンガン mno 2 二酸化鉛 pbo 2 二酸化スズ sno 2 硫化水素 h 2 s 硫酸 h 2 so 4 亜硫酸 h 2 so 3 · 覚えなくていい? 高校化学の化学式一覧 21 分子式一覧 211 超基本的な有機物脂肪族の分子式と構造式;主なイオン式一覧・暗記帳 ※イオン式、名称は「隠す」ボタンを押すと隠れます(マウスカーソルをのせると表示されます)。 「表示する」ボタンを押すと再び表示されます。 ※「ランダムに並べ替え」ボタンを押すとイオン式、名称をランダムに並べ替えます。 「 」「 」を押すと各項目の順番に並べ替えます。 「元の順番に戻す」ボタンを押すと元の順番に




高校有機化学 成分元素の検出と元素分析 組成式の決定2パターン 受験の月
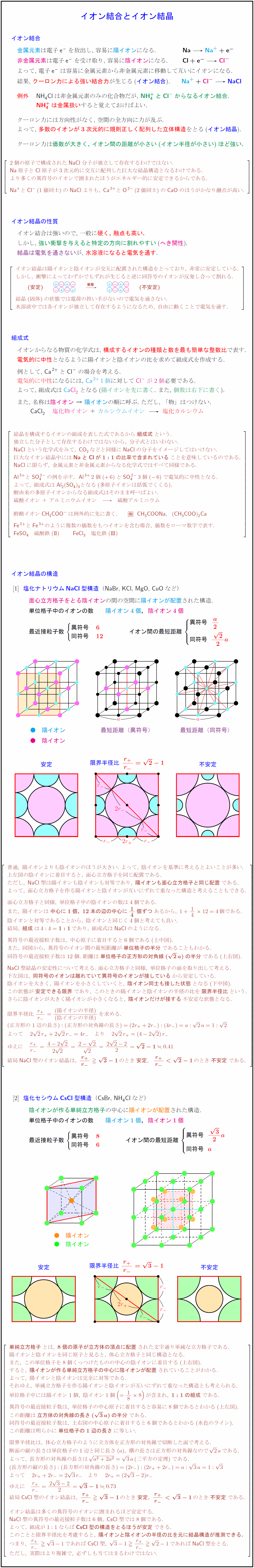



高校理論化学 イオン結合とイオン結晶 Nacl型 Cscl型構造 イオン限界半径比 受験の月
· 高校で学習するイオン式を一覧表にまとめました。 中間テスト、期末テスト、受験などに必須ですのでしっかり学習しておきましょう。 イオンを表すには、構成する原子と電荷を表記します。 イオン式は、原子の種類を元素記号で、その数を右下の数字で表し、右上に電荷の数を示します · 組成式算出の友 CFP Tool 104 元素分析の結果から組成式を算出 (公開 1K) HPA Viewer 0 ヘテロポリ酸分子模型を表示するプログラム (公開 408K) · こんにちは、おのれーです。 今日から第3章のスタートです。 3章では、原子やイオンなど、物質をつくっている小さな粒子どうしが、どのように結び付いて私たちの目に見えるようなかたまりをつくりだしているのかを見ていきます。 第1回の今回は、イオンに注目をしていきます。




覚えなければいけない有機化合物の名前と構造式の解答 数学 化学講師 佐藤学による受験生に役立つ濃縮ポイントと Etc




組成式とは 分子式との違いも解説 一覧表つき 高校生向け受験応援メディア 受験のミカタ
まずは、陽イオン→陰イオンの順に並べます。 Ca 2 ,Cl となりますね。 次に考えるのは、イオンの数の比です。 カルシウムイオン1つに対して、塩化物イオンが2つ結合しますから、個数比は 12 ですね。 最後に、この比を右下に書くと、 CaCl 2 となります。 名前は 塩化カルシウム ですね。 (2)NH 4 ,SO 42 アンモニウムイオンが1、硫酸イオンは2の電荷を持ちます中和(定義・塩・中和反応式の作り方など) 酸化物の反応(金属元素・非金属元素) 酸性塩・塩基性塩・正塩(違い・見分け方・一覧など) 塩の液性(見分け方・演習問題など) 強酸・弱酸・強塩基・弱塩基(違い・覚え方・一覧など) 弱酸・弱塩基遊離反応原理や公式、反応式の作り�分子式の決定 原子数の比で組成式を決定しました。しかし組成式の比を使ってc 2 h 3 o 2 とわかったとしても、化合物はc 2 h 3 o 2 の可能性、c 4 h 6 o 4 の可能性もあります。 つまりn × 組成式=分子式(nは整数)となります。分子式は組成式の整数倍です
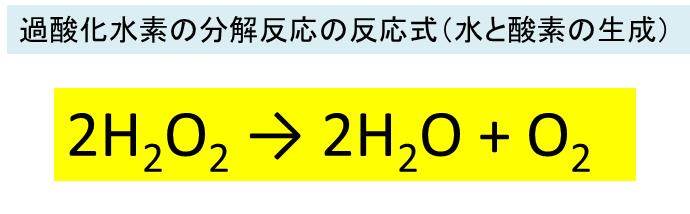



過酸化水素 H2o2 の化学式 分子式 構造式 電子式 分子量は 過酸化水素の分解の反応式は




構造式の書き方 化学の基本として知っておきたいルールとは 高校生向け受験応援メディア 受験のミカタ




高校化学 元素分析と組成式 映像授業のtry It トライイット




覚えなければいけない有機化合物の名前と構造式の解答 数学 化学講師 佐藤学による受験生に役立つ濃縮ポイントと Etc




なぜ結合しないんですか 大至急お願いします Clear




高1 化学基礎 1 これだけは覚えておきたいイオン式 組成式 高校生 Clear



多 原子 イオン と は 高校の化学についてです 多原子イオンで例えば Nh4 とかは Nが
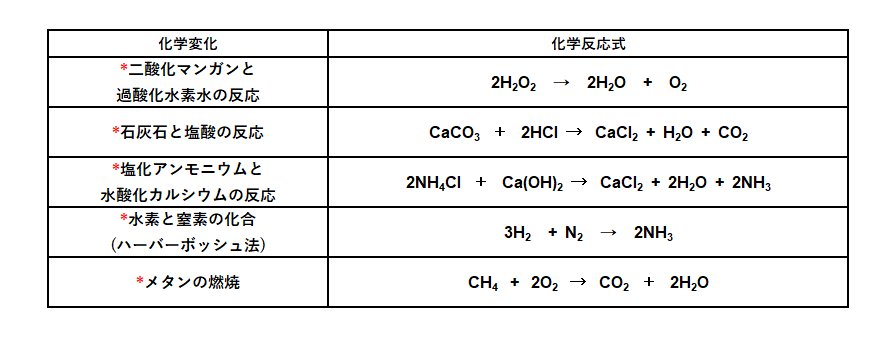



化学反応式まとめ 中学理科 ポイントまとめと整理



高校化学のイオンの問題で 陽イオンと陰イオンの組み合わせができる Yahoo 知恵袋




化学基礎テ対 物質の構成 化学結合 高校生 化学のノート Clear 化学結合 化学 高校 勉強
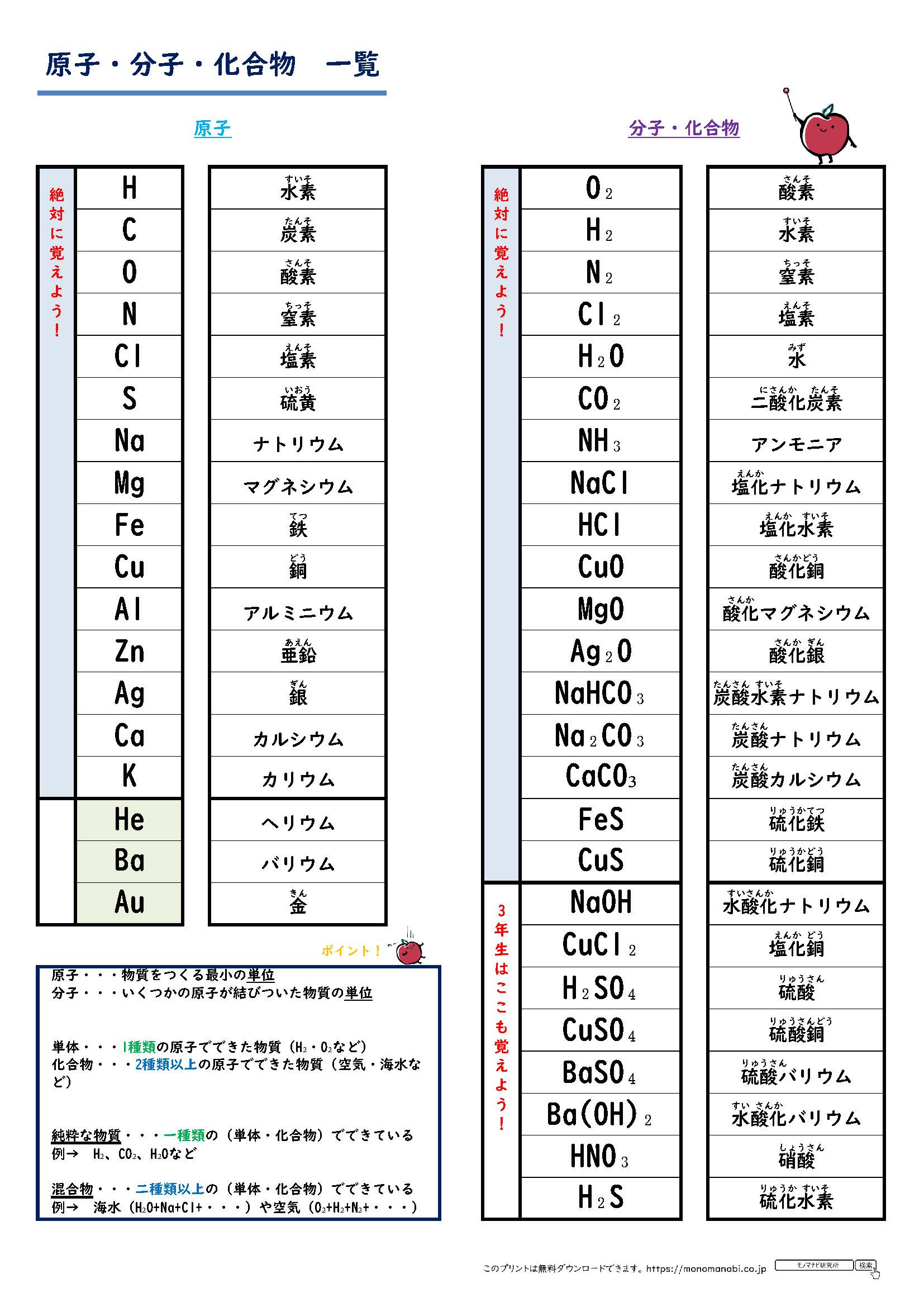



化学式 一覧 化学 完全版 酸 塩基の価数の意味 覚え方 一覧と多段階電離



Qck0d2a9as2853cudbqy0lc6cfz4a0e7e Xyz Kiso Comparison Formular




化学基礎 暗記まとめ 高校生 化学のノート Clear




中2 元素記号 化学式 これだけ覚えれば大丈夫 個別指導塾ノーバス北浦和本校




元素分析と炭素間結合 富岡市の総合学習塾 トータルアカデミー




高校化学 ファンデルワールス力 充填率 組成式と分子式を簡単に解説 高校化学選択をしている受験生や高校生は必見 弁理士を目指すブログ




化学式とは 受験化学で覚えておくべき化学式を一覧にまとめてみた 化学受験テクニック塾




P0rt 42 1 Descubre Como Resolverlo En Qanda



組成式 Japaneseclass Jp
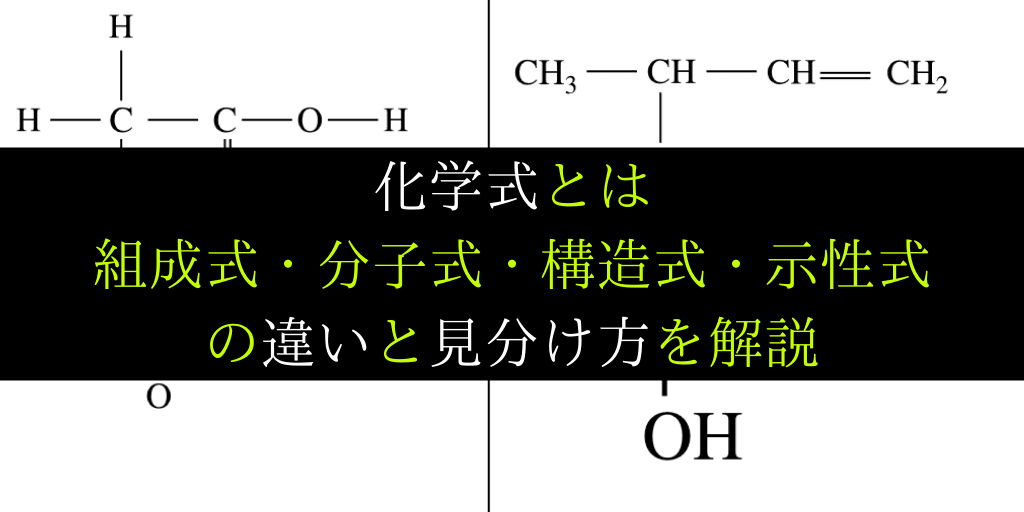



化学式 組成式 分子式 示性式 構造式の違いと見分け方を具体例で解説




化学式とは コトバンク




化学式 一覧 化学 完全版 酸 塩基の価数の意味 覚え方 一覧と多段階電離




塩化カルシウム 組成式




高校化学 組成式の作り方 Youtube




化学基礎 イオン式 Youtube




高校化学が苦手な受験生必見 化学反応式の覚え方のコツをご紹介 予備校いくなら逆転合格の武田塾




Images Of イオン反応式 Japaneseclass Jp




メルカリ 高等学校 化学1 化学2 改訂版 文学 小説 900 中古や未使用のフリマ




高校化学 組成式 分子式の決定 練習編 映像授業のtry It トライイット




イオン反応式 Japaneseclass Jp



化学の組成式で 不定期に2とか3がついたり がついたり どうい Yahoo 知恵袋




解答の3行目の Cho2 N 45n 90という式について なぜ45nなのですか Clear



山崎高校 化学 授業支援システム




塩化カルシウム 組成式 かっこ




セ対 これだけは覚える 化学式一覧 高校生 化学のノート Clear




高校有機化学 炭化水素の分類 鎖式と環式 飽和と不飽和 受験の月




高校有機化学 有機化合物の表現 構造式 示性式 分子式 組成式 と代表的な官能基まとめ 受験の月




組成式の式量を求めなさい という問題です これはどのように計算し 化学 教えて Goo




高校化学 分子式と示性式 映像授業のtry It トライイット



理科総合




高校の化学についてです 二分子のシクロデキストリンの中にフラーレ 化学 教えて Goo




化学式 Wikipedia




組成式とは 分子式との違いも解説 一覧表つき 高校生向け受験応援メディア 受験のミカタ



1




セ対 これだけは覚える 化学式一覧 高校生 化学のノート Clear



1
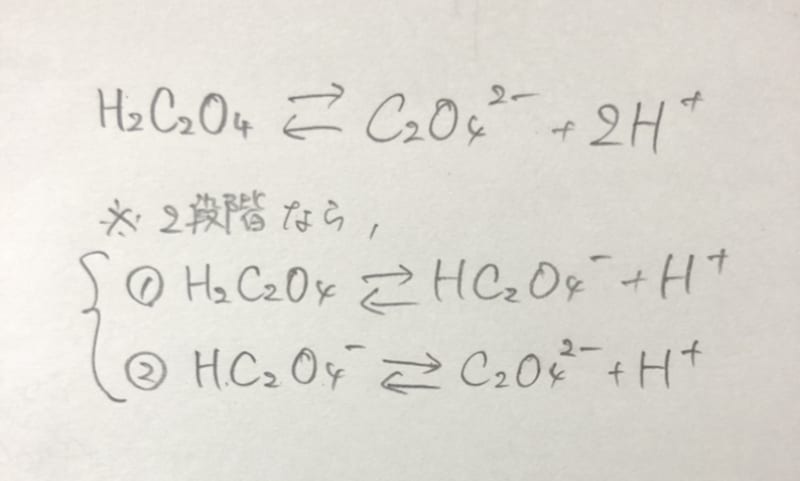



シュウ酸の電離式を教えてください アンサーズ



イオン結合 例 共有結合との違い 特徴 強さなど 化学のグルメ




危険物資格取得のための高校化学no 10 組成式 F M サイエンスブログ




5 3 Descubre Como Resolverlo En Qanda




化学式 化学反応式 下敷き チャート式 数研オリジナルグッズ 数研出版 チャート式の数研出版




組成 式 分子式 違い Article



難易度が格段に上がる 中2理科 理論の1分野 暗記の2分野




高校化学 分子結晶の沸点 黒鉛の電気伝導性を簡単に解説 高校化学選択をしている受験生や高校生は必見 弁理士を目指すブログ




化学式 一覧
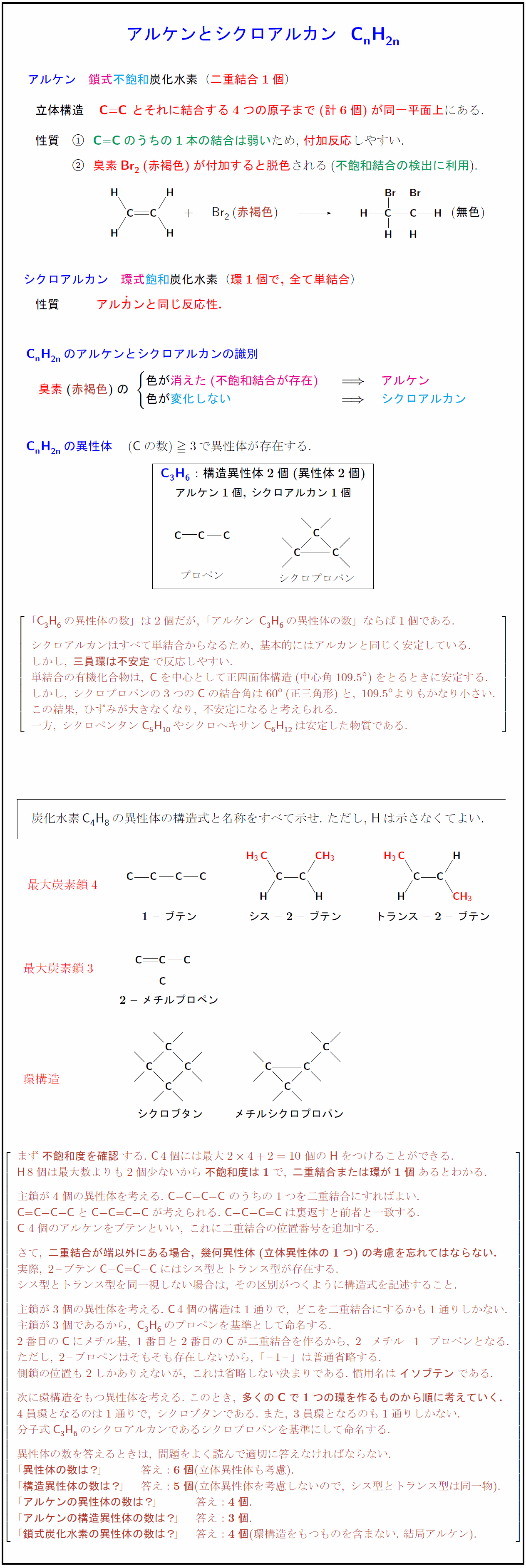



高校有機化学 アルケンとシクロアルカンの性質と異性体まとめ 受験の月




高校化学 結合 イオン結合 組成式の書き方 オンライン無料塾 ターンナップ Youtube



金と銀とクリスタルの化学組成式や元素記号を教えて下さい 金 Au銀 Yahoo 知恵袋



物質の構造と構成 の記事一覧 2 4ページ目




組成 式 一覧 ガラスの種類と組成 ガラスの基礎知識 国内大手加工ガラスメーカーのガラス情報専門サイト 三芝硝材



酸化銀 I Iii You Iggy




高校生 組成式のノート一覧 Clear




楽天ブックス 定期テストやれば得点できるワーク化学基礎 忙しい高校生向け 田中弘美 本




高校化学基礎 組成式の書き方 映像授業のtry It トライイット




組成 式 一覧 元素 化合物の種類と化学式の一覧
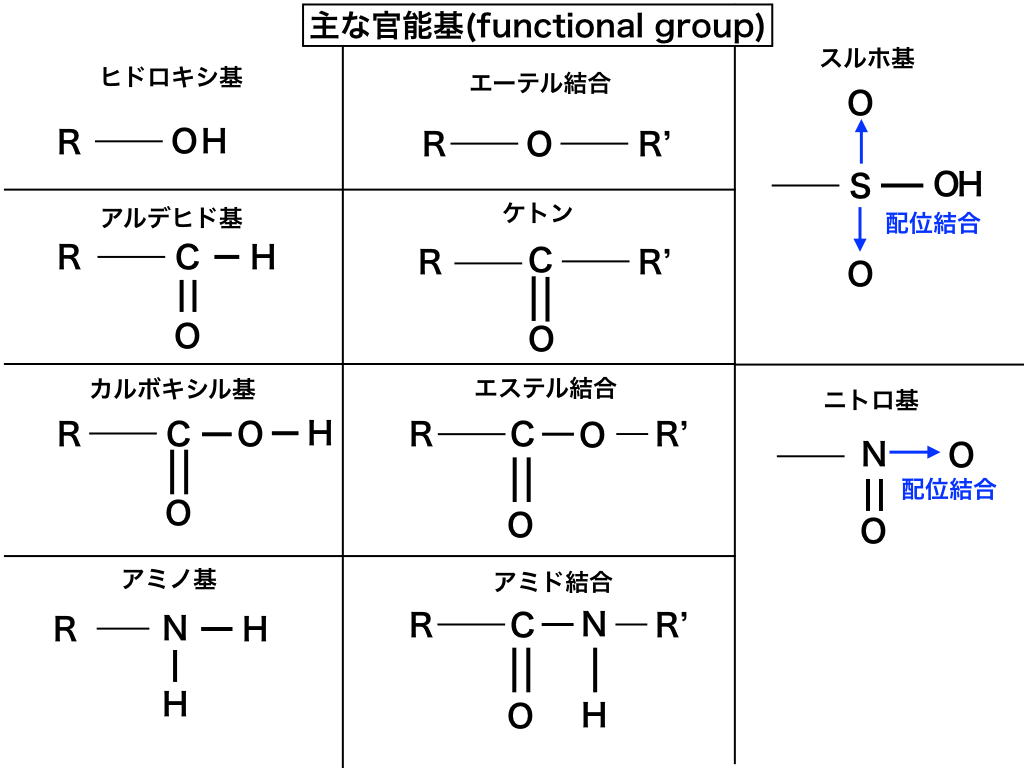



化学式 組成式 分子式 示性式 構造式の違いと見分け方を具体例で解説




電離式の一覧 中学生用




質問 化学 高校 組成式 化学式 分子式の違いはなんですか オンライン無料塾 ターンナップ



化学式とは その意味から大学受験に役立つ化学反応式の覚え方まで Studyplus スタディプラス




高校化学 構造式 映像授業のtry It トライイット
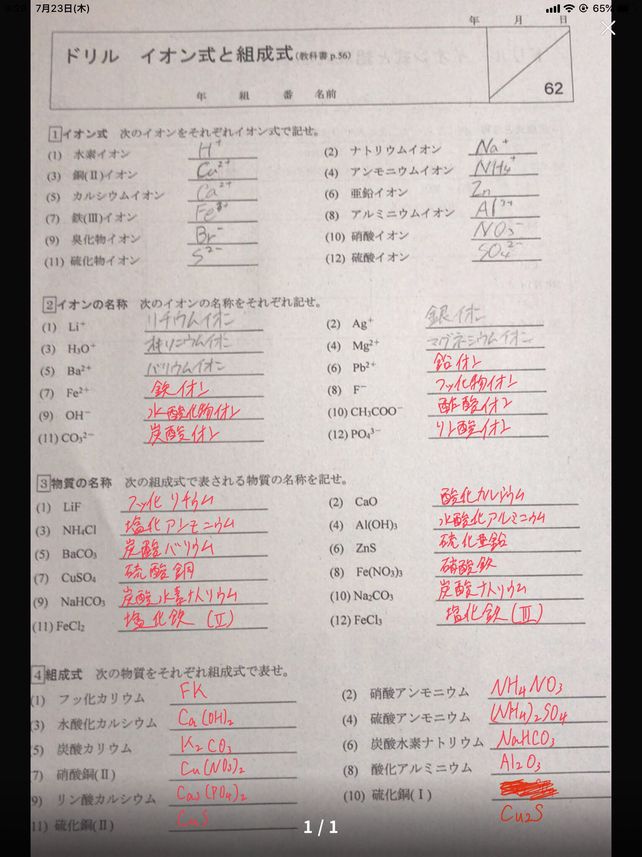



1 11 Cait 4 Dfracm Descubre Como Resolverlo En Qanda



硫酸水素マグネシウム You Iggy




1 2 1 イオン結晶と組成式 化学基礎 Youtube



Q Tbn And9gcssqz9tuetvs62uxrdhpvyjzko2wugy0iaegnq0qyi2 Avo8wmm Usqp Cau



組成式の作り方について プラス マイナスのイオンの比で右上の数字が比 Yahoo 知恵袋




高校化学基礎 構造式とは 映像授業のtry It トライイット




イオンの組成式についてなんですけど 右下の硫酸アルミニウムで なぜ3 2 2 3にな Clear



トップ 100 組成式 一覧 すべての鉱山クラフトのアイデア




高校 化学基礎 要点整理 化学結合 2 Youtube
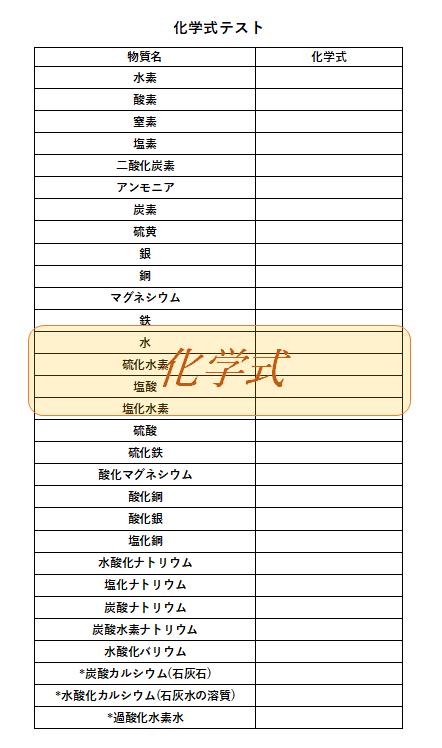



化学式記号 Tourotom1 1



化学式と化学反応式のテスト まめどらの理科準備室から飛び出そう



リン酸マグネシウム You Iggy
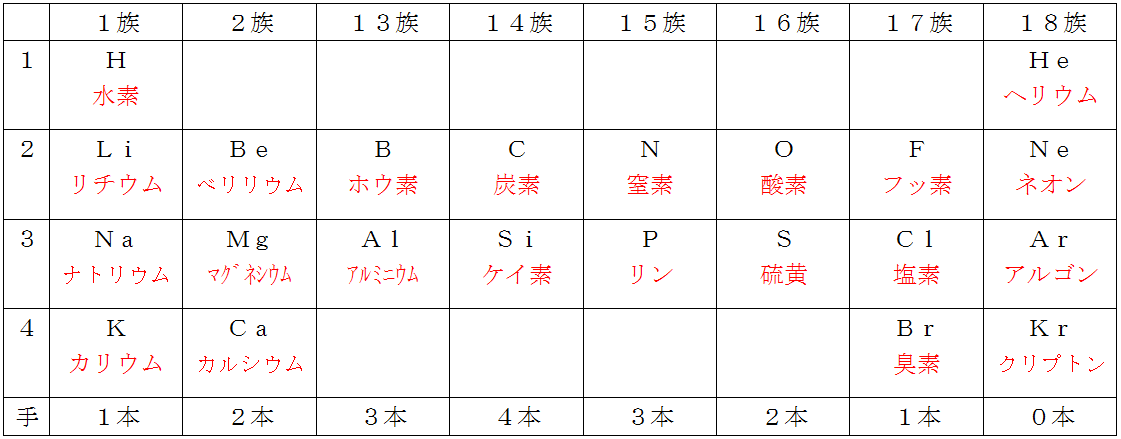



理科4ページ目 三重の個人契約家庭教師




メルカリ 高等学校 新化学基礎 第一学習社 参考書 800 中古や未使用のフリマ



化学基礎の組成式なんですけど あってますか 赤と黒の違いは気 Yahoo 知恵袋




P0rt 42 1 Descubre Como Resolverlo En Qanda




高1 化学 高一 イオン 周期表など 高校生 化学のノート Clear




組成 式 一覧



中学で覚えるイオン 酸とアルカリ 3年理科 Takaの授業記録11




高校有機化学 脂肪族化合物の構造決定問題演習 受験の月



0 件のコメント:
コメントを投稿